L’EMA, l’Agenzia Europea per i Medicinali, ha chiesto, in forma precauzionale che tutte le aziende e gli enti che hanno a che fare con il commercio di farmaci nell’Unione Europea si accertino che in quei farmaci non siano presenti tracce di N-nitrosodimetilammina, una sostanza considerata «probabilmente cancerogena» dall’Agenzia internazionale per la ricerca sul cancro dell’Organizzazione Mondiale della Sanità (OMS), sulla base di studi condotti su animali. Il comunicato dell’EMA è arrivato dopo che il 24 settembre l’Agenzia Italiana del Farmaco aveva vietato l’utilizzo di farmaci contenenti ranitidina, perché in alcuni di essi erano appunto state trovate tracce di N-nitrosodimetilammina.
I farmaci oggetto del ritiro
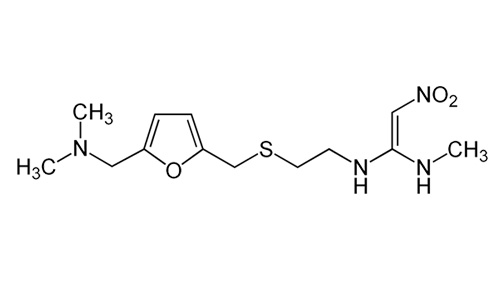
Tutti i farmaci ritirati dal mercato per ordine dell’AIFA sono prodotti a base di ranitidina, una molecola simile all’istamina che non permette a quest’ultima di legare i recettori H2 presenti sulle cellule della parete dello stomaco. Questi sono dei recettori che, se attivati dall’istamina, inducono secrezione di acido gastrico. Il legame della ranitidina occupa i recettori senza determinarne un’attivazione, impedendo così all’istamina di svolgere la sua funzione.
In alcuni dei lotti di ranitidina, tuttavia, le autorità competenti hanno rinvenuto la presenza di un composto anomalo. Si tratta della NDMA (N-nitrosodimetilammina), ovvero un composto appartenente alla famiglia delle nistrosammine.
Generalmente l’esposizione a NDMA avviene attraverso l’ingestione di acqua contaminata ed è certamente presente in alcuni pesticidi. A seguito di esperimenti condotti su modelli animali, questa sostanza è stata considerata potenzialmente cancerogena per l’uomo.
L’NDMA è associato al cancro gastrico e del colon, sebbene studi sull’esposizione attraverso l’acqua non ve ne siano stati e si ritenga che esposizioni a quantità estremamente basse possano risultare poco importanti.
Nel caso dell’azienda farmaceutica, la sua presenza potrebbe indicare un malfunzionamento degli impianti di produzione, sui quali si stanno già effettuando i necessari controlli.
L’Azienda Italiana del Farmaco, ritirando dal mercato molti lotti di prodotti ha preso una precauzione importante. Non è detto, infatti, che in tutte le partite di farmaci contenti ranitidina indiana vi siano tracce di NDMA, ma essendo in gioco la salute dei cittadini non è possibile evitare controlli molto serrati.
Nella sua nota, l’AIFA, evidenzia come si stiano intraprendendo analisi per controllare anche tutti gli altri farmaci a base della stessa sostanza prodotta in altri stabilimenti e come decisioni analoghe sono state prese, in passato, anche in altre situazioni ed in altri Paesi Europei.
Per tutti coloro che sono in trattamento con uno dei farmaci presenti nella lista il consiglio di AIFA è quello di recarsi dal proprio medico per valutare un cambio terapeutico nel più breve tempo possibile, senza la necessità di sospendere la terapia.